|
1 |
Sebanyak 11,1 gram CaCl2 (Ar Ca = 40, Cl = 35,5) dilarutkan dalam air sampai volume 500 ml. Konsentrasi ion Cl- yang berada dalam larutan tersebut adalah… |
|
|
A |
0,40 M |
|
|
B |
0,30 M |
|
|
C |
0,20 M |
|
|
D |
0,10 M |
|
|
E |
0,05 M |
|
|
2 |
Konsentrasi glukosa dalam air adalah 7.5 molal .Jika tetapan penurunan titik beku molal Kf = 1.86, maka penurunan titik beku larutan glukosa adalah…°C |
|
|
A |
1.4 |
|
|
B |
-1.4 |
|
|
C |
-14 |
|
|
D |
14 |
|
|
E |
27 |
|
|
3 |
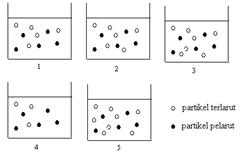
Perhatikan gambar mol zat terlarut pada beberapa larutan berikut
Gambar yang menunjukkan tekanan uap larutan paling kecil adalah… |
|
|
A |
1 |
|
|
B |
2 |
|
|
C |
3 |
|
|
D |
4 |
|
|
E |
5 |
|
|
4 |
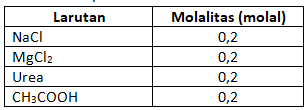
Perhatikan data beberapa larutan berikut:
Urutan titik didih dari yang paling tinggi sampai yang paling rendah adalah… |
|
|
A |
Urea – CH3COOH – MgCl2 – NaCl |
|
|
B |
Urea – CH3COOH – NaCl – MgCl2 |
|
|
C |
MgCl2 – NaCl – CH3COOH – urea |
|
|
D |
NaCl – MgCl2 – CH3COOH – urea |
|
|
E |
CH3COOH – Urea – NaCl – MgCl2 |
|
|
5 |
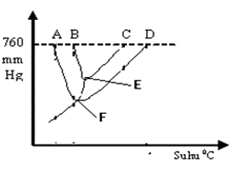
Perhatikan gambar diagram PT air dan larutan urea 0,2 M berikut:
Titik didih dan titik beku larutan 0.2 M urea ditunjukan oleh titik… |
|
|
A |
D dan A |
|
|
B |
B dan C |
|
|
C |
B dan D |
|
|
D |
E dan F |
|
|
E |
A dan D |
|
|
Tekanan osmosis suatu larutan non elektrolit pada suhu 27 ⁰C adalah 2.46 atm jika R = 0.082 maka jumlah mol zat terlarut per liter larutan adalah… |
||
|
A |
0.01 mol |
|
|
B |
0.02 mol |
|
|
C |
0.10 mol |
|
|
D |
0.20 mol |
|
|
E |
0.50 mol |
|
|
Larutan yang isotonis dengan larutan 0.3 M NaCl adalah… |
||
|
A |
Na3PO4 0.2 M |
|
|
B |
Al2(SO4)3 0.1 M |
|
|
C |
C6H12O6 0.5 M |
|
|
D |
FeCl3 0.25 M |
|
|
E |
K2CrO4 0.2 M |
|
|
Jika R = 0.082, maka tekanan osmosis larutan CaCl2 0.01 M pada suhu 27⁰C adalah… (Ar Ca = 40, Cl = 35.5) |
||
|
A |
0.22 atm |
|
|
B |
0.246 atm |
|
|
C |
0.660 atm |
|
|
D |
0.738 atm |
|
|
E |
1.246 atm |
|
|
Di antara persamaan reaksi berikut, yang merupakan persamaan reaksi redoks adalah….. |
||
|
A |
KOH(aq) + HCl(aq) → KCl(aq) + H2O(l) |
|
|
B |
AgNO3 (aq) + HCl(aq) → AgCl(s) + HNO3 (aq) |
|
|
C |
CO2 (g) + Ba(OH)2 (aq) → BaCO3 (s) + H2O(l) |
|
|
D |
Mg(s) + HCl(aq) →MgCl2 (aq) + H2 (g) |
|
|
E |
H2CO3 (aq) → CO2 (g) + H2O(l) |
|
|
Untuk reaksi redoks:
Harga a, b, c dan d berurutan adalah… |
||
|
A |
3, 6, 5 dan 3 |
|
|
B |
3, 5, 6 dan 3 |
|
|
C |
3, 6, 5 dan 2 |
|
|
D |
3, 6, 5 dan 1 |
|
|
E |
3, 5, 6 dan 2 |
|
|
Berdasarkan data di bawah ini:
Reaksi Sel volta yang berlangsung tidak spontan adalah… |
||
|
A |
Zn(s)/Zn2+(aq) // Ag+/Ag(s) |
|
|
B |
Mg(s)/Mg2+(aq) // Fe2+(aq)/Fe(s) |
|
|
C |
Al(s)/Al3+(aq) // Ag+(aq)/Ag(s) |
|
|
D |
Al(s)/Al3+(aq) // Fe2+(aq) /Fe(s) |
|
|
E |
Zn(s)/Zn2+(aq) // Mg2+ (aq)/Mg (s) |
|
|
Pada reaksi redoks:
Pernyataan yang tepat untuk reaksi tersebut adalah… |
||
|
A |
Cl2 menjadi Cl- mengalami oksidasi |
|
|
B |
IO3- bertindak sebagai oksidator |
|
|
C |
Cl2 menerima 2 elektron |
|
|
D |
IO3- dan Cl2 zat yang melepaskan elektron |
|
|
E |
IO4- merupakan hasil reduksi |
|
|
Logam besi dicelupkan ke dalam larutan AgNO3 1 M pada suhu 25°C. Jika diketahui Fe2+|Fe E°= –0,44 V dan Ag+|Ag E° = + 0,80 V. Pernyataan yang benar adalah… |
||
|
A |
Fe mereduksi ion Ag+ |
|
|
B |
Ag mereduksi logam Fe |
|
|
C |
Fe mengoksidasi ion Ag+ |
|
|
D |
Tidak terjadi reaksi sel |
|
|
E |
Ion Fe2+ menjadi ion Fe3+ |
|
|
Pada elektrolisis lelehan MgCl2 dengan elektroda grafit, dikatoda akan dihasilkan… |
||
|
A |
Gas klorin |
|
|
B |
Gas hidrogen |
|
|
C |
Larutan Mg(OH)2 |
|
|
D |
Logam Mg |
|
|
E |
Gas oksigen |
|
|
Reaksi yang terjadi di katoda adalah…
|
||
|
A |
NO3-(aq) → NO2 + e |
|
|
B |
Ag+(aq) + e → Ag(s) |
|
|
C |
Ag(s) → Ag+(aq) + e |
|
|
D |
2H2O(l) + 2e → 2OH–(aq) + H2(g) |
|
|
E |
2H2O(l) → 4H+(aq) + O2(g) + 4e |
|
|
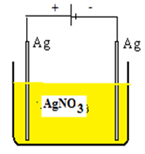
Proses penyepuhan perhiasan cincin dari logam besi yang akan dilapisi logam emas, digunakan larutan elektrolitnya AuCl3. Cincin dari logam besi (Fe) sebagai katode dan logam emas (Au) sebagai anode. Jika cincin besi akan dilapisi emas sebesar 0,05 gram dan arus listrik yang digunakan sebesar 0,1 Ampere, maka banyaknya waktu yang diperlukan untuk terjadinya proses tersebut adalah….(Ar Au = 197, tetapan faraday = 96500) |
||
|
A |
7,35 detik |
|
|
B |
24,49 detik |
|
|
C |
244,92 detik |
|
|
D |
735 detik |
|
|
E |
7355 detik |
|
|
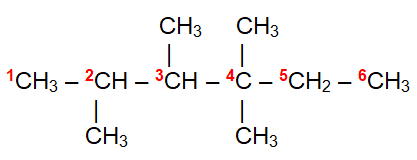
Berdasarkan rumus bangun senyawa hidrokarbon di bawah ini:
Yang merupakan atom C sekunder dan atom C tersier adalah… |
||
|
A |
1 dan 2 |
|
|
B |
1 dan 4 |
|
|
C |
4 dan 5 |
|
|
D |
5 dan 6 |
|
|
E |
5 dan 3 |
|
|
Perhatikan rumus molekul berikut ini:
Hidrokarbon yang merupakan satu deret homolog/keluarga adalah… |
||
|
A |
1 dan 2 |
|
|
B |
1 dan 3 |
|
|
C |
2 dan 3 |
|
|
D |
1 dan 4 |
|
|
E |
2 dan 4 |
|
|
Nama senyawa dengan rumus struktur:
adalah… |
||
|
A |
2,4 – metil pentena |
|
|
B |
2 – pentena |
|
|
C |
2,4 – dimetil – 1 – pentena |
|
|
D |
2,4 – dimetil – 2 – pentena |
|
|
E |
2,4 – dimetil pentana |
|
|
Senyawa hidrokarbon yang merupakan isomer 2-metil-2-butena adalah… |
||
|
A |
2-pentena |
|
|
B |
1-butena |
|
|
C |
2-butena |
|
|
D |
2-metil-butana |
|
|
E |
n-butana |
|
|
Suatu senyawa karbon mempunyai rumus empiris CH2. Jika massa molekul relatifnya= 56 maka rumus struktur senyawa karbon itu adalah (ArC = 12, H = 1) |
||
|
A |
(CH3CH2CH3 |
|
|
B |
CH3CH2CH2CH3 |
|
|
C |
CH3CHCH3 |
|
|
D |
CH3CH2CHCH2 |
|
|
E |
CHCCH2CH3 |
|
|
Di antara rumus molekul senyawa berikut ini yang merupakan senyawa hidrokarbon jenuh adalah… |
||
|
A |
C2H2 |
|
|
B |
C2H4 |
|
|
C |
C2H6 |
|
|
D |
C3H4 |
|
|
E |
C3H6 |
|
|
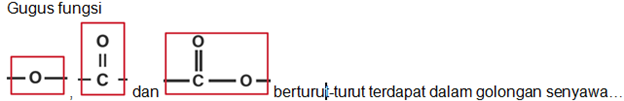
|
||
|
A |
ester, eter dan asam karboksilat |
|
|
B |
eter, ester dan keton |
|
|
C |
eter, aldehida dan ester |
|
|
D |
eter, keton dan ester |
|
|
E |
ester, keton dan eter |
|
|
Senyawa organik dengan rumus molekul C5H12O yang merupakan alkohol tersier adalah… |
||
|
A |
3 – pentanol |
|
|
B |
2 – metil – 2 – butanol |
|
|
C |
2 – metil – 3 – butanol |
|
|
D |
3 – metil – 2 – butanol |
|
|
E |
2,2 dimetil – 1 propanol |
|
|
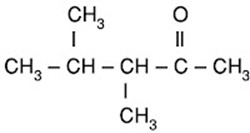
Perhatikan rumus senyawa :
Nama yang benar untuk senyawa itu adalah… |
||
|
A |
2,3-dimetil pentanon |
|
|
B |
3,4-dimetil-2-pentanon |
|
|
C |
2,3-dimetil-4-pentanon |
|
|
D |
3,4,4-trimetilbutanon |
|
|
E |
amil metil keton |
|
|
Pasangan senyawa karbon berikut ini yang merupakan pasangan isomer fungsional adalah…. |
||
|
A |
CH3COOH dan CH3OCH3 |
|
|
B |
CH3CH2OH dan CH3OCH3 |
|
|
C |
CH3COOH dan CH3CHO |
|
|
D |
CH3OCH3 dan CH3CHO |
|
|
E |
CH3CH2OH danCH3CHO |
|
|
27 |
Dari hasil percobaan berikut :
Dapat disimpulhan bahwa… |
|
|
A |
X adalah senyawa Alkohol |
|
|
B |
Y adalah senyawa Aldehida |
|
|
C |
Z adalah senyawa Alkanal |
|
|
D |
X adalah senyawa Ester |
|
|
E |
Z adalah senyawa Alkohol |
|
|
28 |
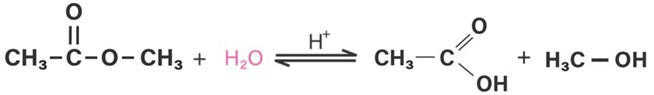
Reaksi berikut:
disebut reaksi… |
|
|
A |
netralisasi |
|
|
B |
penyabunan |
|
|
C |
hidrolisis |
|
|
D |
esterifikasi |
|
|
E |
dekomposisi |
|
|
29 |
Hasil reaksi dari:
|
|
|
A |
etil propil eter |
|
|
B |
propil etil eter |
|
|
C |
etil propanoat |
|
|
D |
dipropil eter |
|
|
E |
propil etanoat |
|
|
30 |
Isomer fungsional asam butanoat adalah… |
|
|
A |
asam isobutanoat |
|
|
B |
dietil eter |
|
|
C |
etil metil keton |
|
|
D |
metil butanoat |
|
|
E |
etil etanoat |
|
CBT Application
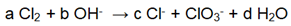
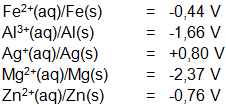
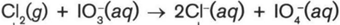

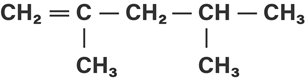

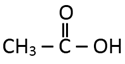
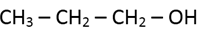 adalah…
adalah…

